Hans-Holger Bleß, Leiter des Bereichs Versorgungsforschung am IGES Institut
Foto: Copyright: Alexander Schuktuew
Nutzenbewertung von Arzneimitteln: intensive Beteiligung externer Sachverständiger mit kontroversen Ergebnissen
Sachverständige aus Wissenschaft und Versorgung beteiligen sich intensiv an der Nutzenbewertung neuer Arzneimittel. Ihre Meinung weicht dabei in drei Viertel der Verfahren in wesentlichen Bereichen von dem bewertenden Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) ab. Unterschiedlich fließen ihre Positionen zudem in den finalen Beschluss des Gemeinsamen Bundesausschusses (G-BA) über den Zusatznutzen neuer Medikamente ein.
Berlin, 12. April 2016 (IGES Institut) – Das zeigt eine Studie des IGES Instituts. In der Studie untersuchten IGES-Wissenschaftler umfassend die Rolle von Drittmeinungen bei der Nutzenbewertung nach dem Arzneimittelmarktneuordnungsgesetz (AMNOG). Einbezogen wurden sämtliche 136 Verfahren, die seit Beginn der Nutzenbewertung im Jahr 2011 bis zum August 2015 regulär abgeschlossen waren.
Das große Interesse externer Experten an einer Beteiligung zeigt sich in der kontinuierlich wachsenden Zahl von Stellungnahmen medizinischer Fachgesellschaften. Diese stieg im Zeitraum 2012 bis 2015 von durchschnittlich 1,6 auf 1,8 Einlassungen je Verfahren. Insgesamt beteiligten sich 60 verschiedene Fachgesellschaften, Berufsverbände und Arbeitsgruppen mit Stellungnahmen an 112 (82 Prozent) der 136 analysierten AMNOG-Verfahren.
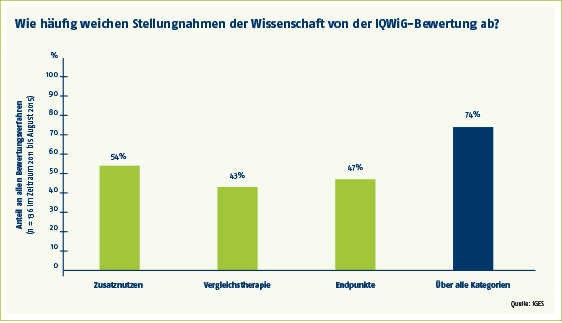
Diskrepanz beim Zusatznutzen bei mehr als jedem zweiten Verfahren
Schwerpunkte der Stellungnehmer sind vor allem drei Bereiche: der patientenrelevante Zusatznutzen, die Vergleichstherapie, der neue Arzneimittel gegenüber gestellt werden, sowie die Endpunkte, an denen der Zusatznutzen gemessen wird. Beim Zusatznutzen urteilen die externen Experten in mehr als der Hälfte (54 Prozent) der Verfahren anders als das IQWiG. Bei der Vergleichstherapie und den Endpunkten sind es 43 bzw. 47 Prozent der Verfahren.
Fachgesellschaften sehen höheren Zusatznutzen als IQWiG und AkdÄ
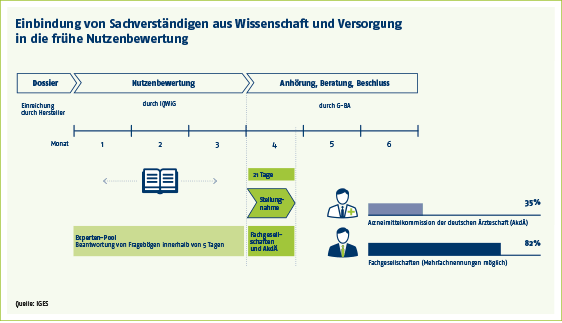
Auffällig ist, dass Fachgesellschaften häufiger und positiver von den Bewertungen des IQWiG abweichen. In 84 Prozent der Stellungnahmen erkennen sie einen höheren Zusatznutzen eines neuen Medikamentes, die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) nur in 18 Prozent.
„Das Ausmaß unterschiedlicher Bewertungen überrascht, urteilen doch alle auf der Basis der gleichen Daten und der Methoden der evidenzbasierten Medizin“, sagt der Studienleiter und Bereichsleiter Versorgungsforschung am IGES Institut, Hans-Holger Bleß. „Offensichtlich ist die frühe Nutzenbewertung kein mechanisches Verfahren, sondern lässt unterschiedliche Interpretationen zu, auch wenn es um eine objektive Einstufung des patientenrelevanten Zusatznutzens gehen soll.“
G-BA stimmt häufiger mit AkdÄ überein als mit Fachgesellschaften
Unterschiedlich berücksichtigt der G-BA in seinem finalen Beschluss die Einlassungen externer Sachverständiger. Beispiel Zusatznutzen: Hier stimmt er häufiger mit der AkdÄ als mit den Fachgesellschaften überein, in 69 Prozent versus 51 Prozent der Stellungnahmen.
„Mit ihrer intensiven Beteiligung tragen wissenschaftliche Experten zu einer sachgerechten Nutzenbewertung bei. Ihre Einbindung sollte gestärkt werden und transparenter erfolgen“, sagt Bertram Häussler, Leiter des IGES-Instituts. Er verwies dabei auf internationale Beispiele. So setze sich in Großbritannien das Beschlussgremium anders als der G-BA zu zwei Dritteln aus Vertretern der Wissenschaft und ambulant tätigen Ärzten zusammen.
Experten wünschen sich intensiverer Beteiligung bei IQWiG-Befragung
Auch das IQWiG selbst befragt Experten im Rahmen seines Bewertungsprozesses. Dies erfolgt über Fragebögen, die Sachverständige innerhalb von fünf Tagen zurücksenden müssen. Zu den Fragen und Antworten sowie ihrer Berücksichtigung im Bewertungsprozess macht das IQWiG keine Angaben. Wie eine im Rahmen der IGES-Studie durchgeführte Befragung zeigt, empfinden die involvierten Experten Bearbeitungszeit, Aufklärung und Verwertung ihrer Einlassungen als unzureichend. Dennoch signalisieren sie hohes Interesse und die Bereitschaft, sich intensiver am Bewertungsprozess zu beteiligen.
Die Studie „Auswirkungen von Stellungnahmen der Wissenschaft in der Nutzenbewertung von Arzneimitteln“ entstand im Auftrag des forschenden Arzneimittelherstellers Takeda.
Hintergrund:
Beteiligung externer Sachverständiger aus Wissenschaft und Versorgung an der Nutzenbewertung neuer Arzneimittel
Drittmeinungen sind im Verfahren der Nutzenbewertung neuer Arzneimittel nach dem Arzneimittelmarktneuordnungsgesetz (AMNOG) an zwei Stellen vorgesehen: Zum einen befragt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) externe Experten. Das IQWiG bewertet den Zusatznutzen neuer Wirkstoffe anhand eingereichter Unterlagen der pharmazeutischen Unternehmen, der Dossiers. Dies geschieht im Auftrag des Gemeinsamen Bundesausschusses (G-BA).
Zum anderen ermöglicht der G-BA in einem Anhörungsverfahren selbst wissenschaftliche Stellungnahmen, bevor er abschließend über den Zusatznutzen neuer Präparate entscheidet.
Sachverständige sollen ihr Wissen bezüglich des jeweiligen Therapiegebiets und der Versorgungssituation mit einbringen. Sie haben aber kein eigenes Stimmrecht.